|
|
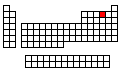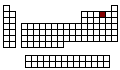
Elementos Químicos |
|
ELEMENTOS QUÍMICOS |
|
Configuración Electrónica
Propiedades El gas oxígeno, O2 , es incoloro, inodoro e insípido. Es ligeramente más denso que el aire, y es poco soluble en el agua (48,9 cm³ por litro en c.n.) por lo que puede recogerse sobre ella. El oxígeno gaseoso puede condensarse en un líquido azul pálido que es fuertemente magnético. El oxígeno sólido azul pálido se obtiene por compresión del líquido. Se conocen tres formas estructurales de oxígeno: el oxígeno ordinario, con dos átomos por molécula, (O2), el ozono, con tres átomos por molécula, (O3) y una forma no magnética de color azul pálido, O4 , que contiene cuatro átomos por molécula, que se rompe fácilmente en presencia de oxígeno ordinario. El ozono es de color azul pálido y tiene un olor irritante. El ozono es poco soluble en agua y se disuelve en tetracloruro de carbono con mayor facilidad. A temperatura ambiente es relativamente inestable y se descompone según la reacción: O3 = O2 + O que explica que su poder oxidante sea aún más alto que el del oxígeno. Se conocen tres isótopos estables del oxígeno siendo el 16O el más abundante. Comprende el 99,76% del oxígeno ordinario y se usó como patrón en la determinación de pesos atómicos hasta el decenio de 1960. Valores de las Propiedades
A temperatura ambiente no es muy activo, pero a temperaturas elevadas se combina con la mayor parte de los elementos para formar óxidos, incluyendo algunos de los gases nobles, en especial si se trata de oxígeno puro y en presencia de catalizadores. El oxígeno es el segundo elemento más electronegativo, después del flúor, y esta avidez por capturar electrones explica que se combine con la mayoría de los elementos. Si exceptuamos el nitrógeno, los halógenos, el oro, el iridio y el platino, todos los elementos pueden arder en el oxígeno. De la misma forma, los compuestos que contengan elementos que se combinen fácilmente con el oxígeno, arden en el seno de éste. Resumen de Reactividad
|
Momento lineal | La Luz | Cinemática | Gases | Geografía | Clima | Moléculas 3D | Formularios | Catálogo Educaplus © 1996-2024, www.educaplus.org
 Menú Educaplus
Menú Educaplus