|
|
Elementos Químicos |
|
ELEMENTOS QUÍMICOS |
|
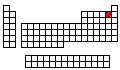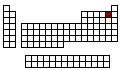
Configuración Electrónica
Propiedades El flúor es un gas de color amarillo pálido, ligeramente más pesado que aire, corrosivo y de olor penetrante e irritante. Es sumamente tóxico y es el no metal más reactivo.
Valores de las Propiedades
Es muy oxidante y forma fluoruros, que figuran entre los más estables de todos los compuestos químicos, directamente con casi todos los elementos e indirectamente con el nitrógeno, cloro, y oxígeno. Debido a su gran actividad muchos metales, la madera y el vidrio arden en contacto con él. A temperatura ordinaria, sin necesidad de aporte de energía alguno, cuando entra en contacto con el hidrógeno produce una reacción explosiva. El flúor debe manejarse con mucha precaución. El ácido fluorhídrico (fluoruro de hidrógeno, HF o H2F2), es uno de los compuestos de flúor más importantes, se prepara calentando fluoruro de calcio con ácido sulfúrico. La solución acuosa de este ácido, de uso comercial generalmente, se obtiene pasando los vapores anhidros de fluoruro de hidrógeno a través de un recipiente de plomo que contiene agua destilada, quedando así el ácido en forma diluida. El ácido fluorhídrico es sumamente corrosivo y debe conservarse en plomo, acero o recipientes plásticos. El ácido fluorhídrico disuelve el vidrio, por lo que se utiliza para diversas formas de grabado del mismo, tal como marcar las divisiones para los termómetros y diseños en la cristalería y cerámicas. Resumen de Reactividad
|
Momento lineal | La Luz | Cinemática | Gases | Geografía | Clima | Moléculas 3D | Formularios | Catálogo Educaplus © 1996-2024, www.educaplus.org
 Menú Educaplus
Menú Educaplus